Mardi 17 janvier, Moderna a annoncé avoir obtenu des résultats préliminaires positifs lors d’un essai de phase 3 visant à évaluer l’efficacité, chez les personnes âgées, d’un vaccin à ARN messager (ARNm) dirigé contre le virus respiratoire syncytial (VRS), responsable de la bronchiolite.
La pandémie due au coronavirus SARS-CoV-2 avait déjà révélé le formidable potentiel de ce type de vaccins. Développés en quelques mois, ils ont rapidement permis de contenir les vagues successives de Covid-19, et de limiter leurs dégâts.
Au cœur de ce succès se trouve, bien entendu, la molécule d’ARNm. Mais tout le crédit ne lui revient pas : d’autres actrices, moins connues, contribuent largement à l’efficacité de ces vaccins. Il s’agit des nanoparticules lipidiques, qui non seulement « encapsulent » l’ARNm pour le protéger et le transporter, intact, à l’intérieur des cellules, mais exacerbent aussi la réponse immunitaire. Ce qui présente des avantages, mais également certains inconvénients. Explications.
L’ARN ne fait pas tout
Alors que les vaccins classiques contenaient des fragments du virus contre lequel on cherchait à « éduquer » le système immunitaire (ou bien ledit virus « inactivé » ou « atténué »), les vaccins à ARNm ne contiennent qu’un « plan de montage » : la molécule d’ARNm. Après injection, celle-ci pénètre dans les cellules où elle sera lue et utilisée pour fabriquer un fragment de virus qui stimulera les défenses immunitaires (l’« antigène », terme désignant un élément reconnu comme étranger par l’organisme). Ainsi « éduqué », le système immunitaire sera prêt à réagir s’il devait, plus tard, croiser le virus lui-même.
Les molécules d’ARNm sont donc centrales dans les vaccins à ARN. Mais seules, elles ne serviraient pas à grand-chose. Très fragiles, elles se dégradent en effet très rapidement, en particulier en présence d’enzymes, très nombreuses dans notre organisme.
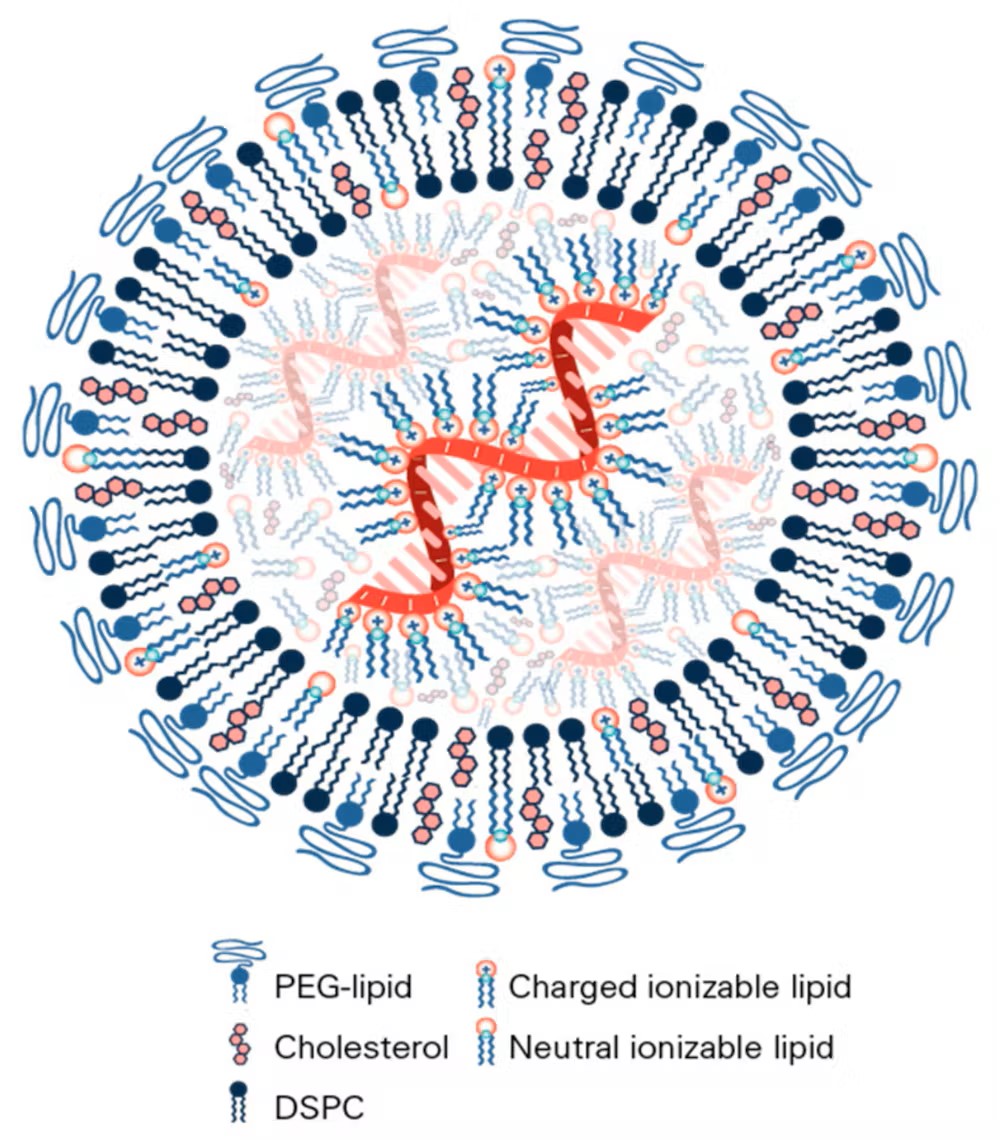
Pour les protéger et s’assurer qu’elles arrivent à bon port après injection, les ARNm sont « emballés » dans de minuscules « nanocapsules » lipidiques. Les vaccins à ARN sont donc des « nanovaccins ». Précisons que ces nanoparticules lipidiques n’ont rien à voir avec les nanoparticules toxiques qui font actuellement débat.
Les nanoparticules vaccinales sont constituées de quatre éléments essentiels :
- des lipides ionisables, chargés positivement, qui se lient aux charges négatives de l’ARN messager ;
- des phospholipides (des constituants essentiels des membranes cellulaires) ;
- du cholestérol (autre constituant essentiel des membranes cellulaires, en association avec les phospholipides) ;
- des lipides conjugués à des chaînes de polyéthylène glycol, qui stabilisent l’ensemble.
Michael D. Buschmann M. D. et al (2021) « Nanomaterial Delivery Systems for mRNA » — Vaccines
In vivo, les lipides ionisables qui constituent les nanoparticules vaccinales permettent à celles-ci d’entrer dans la cellule en étant internalisées dans des sortes de vésicules appelées endosomes. Une fois dans la cellule, l’ARN est libéré, lu et traduit en protéines. Reconnues étrangères par l’organisme, ces dernières déclenchent la réponse vaccinale.
Les nanoparticules lipidiques protègent donc l’ARN d’une dégradation rapide et assurent sa captation par les cellules au site d’injection. Elles exercent aussi d’autres actions déterminantes pour l’efficacité des vaccins à ARN. Mais elles sont aussi impliquées dans certains de leurs effets indésirables.
Effet adjuvant et stimulation des réponses immunes
Comme tout vaccin, les vaccins à ARN doivent stimuler les cellules immunitaires appelées « cellules présentatrices d’antigène » pour qu’une réponse immune efficace se développe.
Dans les vaccins classiques basés sur des protéines antigéniques, cette action de stimulation des cellules présentatrices d’antigène est exercée par un adjuvant présent dans le vaccin. Les vaccins à ARN sont quant à eux dépourvus d’adjuvant, car ce rôle est joué par les lipides chargés positivement qui font partie des nanoparticules.
L’effet adjuvant des nanoparticules lipidiques aboutit à une stimulation robuste des lymphocytes spécifiques de l’antigène dans les ganglions lymphatiques qui drainent le site d’injection. Ces réponses immunes sont plus puissantes que celles obtenues avec les adjuvants classiques et impliquent notamment des cellules immunitaires appelées « lymphocytes T folliculaires », qui orchestrent la production d’anticorps capables de neutraliser le virus avec une très grande efficacité.
Des études menées chez des individus vaccinés ont révélé que ces lymphocytes T folliculaires spécifiques de l’antigène vaccinal peuvent persister plusieurs mois dans les ganglions d’individus vaccinés.
Les mécanismes précis de l’activité adjuvante des nanoparticules lipidiques n’ont été que partiellement élucidés pour l’instant. On sait qu’ils reposent notamment sur la stimulation de différentes populations de globules blancs, en particulier les cellules dendritiques qui présentent les antigènes aux lymphocytes T, et sur la production d’hormones du système immunitaire nécessaires à l’activation des réponses immunes (cytokines et de chimiokines).
Ces messagers chimiques entraînent en parallèle une réaction inflammatoire à l’origine d’effets indésirables, qui définissent la réactogénicité du vaccin, autrement dit sa propension à produire des réactions adverses, le plus souvent bénignes et transitoires.
Effets indésirables avérés et supposés
La réactogénicité des vaccins à ARN se traduit par des symptômes tels que douleur au site d’injection, fièvre, maux de tête, fatigue. Ils surviennent fréquemment, mais disparaissent en quelques jours.
Des travaux récents suggèrent que le polyéthylène glycol pourrait engendrer une réactogénicité plus importante, qui surviendrait chez des individus sensibilisés par une exposition préalable à ce composant via certains produits pharmaceutiques ou cosmétiques. Cependant, le rôle du polyéthylène glycol dans de rares réactions allergiques graves est controversé.
Il arrive aussi que la réaction inflammatoire au vaccin gagne les ganglions des aisselles et du cou qui drainent le site d’injection des vaccins à ARN messager. Ils sont alors le siège d’un gonflement perceptible et parfois gênant. Ce phénomène, très vraisemblablement attribuable aux nanoparticules lipidiques s’observe le plus fréquemment après la deuxième dose du vaccin Moderna.
Dans la très grande majorité des cas, le gonflement disparaît en quelques jours. Lorsqu’il persiste plus de deux semaines, des examens complémentaires sont indispensables pour ne pas retarder le diagnostic d’une pathologie maligne préexistante.
Enfin, la myocardite-post-vaccinale est une complication très rare des vaccins ARN anti-Covid-19, reconnue par les autorités réglementaires. Son pronostic est heureusement favorable, avec une guérison rapide dans la majorité des cas. Si l’implication des nanoparticules lipidiques n’a pas été démontrée, elle est plausible. En effet, ces myocardites font intervenir une importante réaction inflammatoire et une infiltration du cœur par des lymphocytes T. Il pourrait en être de même dans les quelques cas d’hépatite rapportés après vaccination.
Aux confins de la nanomédecine et de l’immunologie
Les vaccins à ARN présentent de nombreux avantages. Ils peuvent être développés très rapidement et produits en masse dès que l’on a déterminé la séquence génétique permettant de produire l’antigène qu’ils contiennent. C’est ainsi que les nouveaux vaccins anti-Covid-19 dirigés contre des sous-variants du variant Omicron ont pu être rendus disponibles en quelques mois seulement.
Autre avantage : un même vaccin peut contenir plusieurs ARNs protégeant contre différents virus ou variants viraux. Ainsi, une équipe américaine vient de produire un vaccin contenant les ARNs codants pour 20 variants de l’hémagglutinine du virus influenza (la protéine qui lui permet de s’arrimer aux cellules qu’il infecte), ouvrant la voie vers un vaccin antigrippe universel. Pour prévenir les infections respiratoires les plus fréquentes, un vaccin ARN qui protège simultanément contre le Covid-19, la grippe et le VRS est aussi en développement.
La capacité des vaccins ARN à induire des réponses immunitaires puissantes constitue un autre atout majeur. Cela permet d’envisager leur utilisation pour le contrôle de virus qui n’ont pu être maîtrisés par des vaccins traditionnels, comme le VIH et le cytomégalovirus. Pour cette même raison, les scientifiques espèrent qu’ils permettront aussi des avancées majeures dans la lutte contre le cancer. Des résultats très prometteurs contre le mélanome malin avancé ont d’ailleurs déjà été rendus publics.
Les vaccins ARN anti-Covid ont donc ouvert une nouvelle ère en vaccinologie, celle des « nanovaccins ». Leur optimisation implique de nouvelles recherches, aux confins de la nanomédecine et de l’immunologie. Les vaccins déployés durant la pandémie de Covid-19 présentaient une balance bénéfice-risque indubitablement positive. Les futurs vaccins à ARN devront quant à eux continuer à faire l’objet d’une surveillance attentive, afin d’identifier les patients à risque de développer des réactions indésirables.![]()
Michel Goldman, Président de l’institut I3h, Université Libre de Bruxelles (ULB)
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
Comment pouvez-vous nous aider à vous tenir informés ?
Epoch Times est un média libre et indépendant, ne recevant aucune aide publique et n’appartenant à aucun parti politique ou groupe financier. Depuis notre création, nous faisons face à des attaques déloyales pour faire taire nos informations portant notamment sur les questions de droits de l'homme en Chine. C'est pourquoi, nous comptons sur votre soutien pour défendre notre journalisme indépendant et pour continuer, grâce à vous, à faire connaître la vérité.