Le 31 août 2022, la Food and Drug Administration (FDA) a approuvé pour les États‑Unis deux nouveaux vaccins de rappel bivalents Covid‑19, respectivement par Pfizer et Moderna.
Les deux vaccins sont dits « bivalents » car ils ciblent à la fois la souche virale originale, ainsi que les dernières souches prévalentes d’Omicron, les sous‑variants BA.4 et BA.5. Ces souches sont actuellement responsables de la quasi‑totalité des nouveaux cas d’infection par le Covid‑19.
Le nouveau vaccin de rappel bivalent de Moderna a été autorisé pour les personnes âgées de 18 ans ou plus, tandis que le rappel de Pfizer a été approuvé pour les personnes âgées de 12 ans ou plus.
Des données provenant de 8 souris
J’ai été surprise de voir cette nouvelle, car aucune donnée clinique relative à ces deux vaccins bivalents BA.4/BA.5 n’a pu être trouvée.
Par exemple, en termes d’essais cliniques, pour les nouveaux vaccins de rappel Omicron de Moderna, il n’existe que des données sur les anticorps neutralisants sériques à un mois pour le vaccin bivalent B.A1 (et non pour le vaccin bivalent BA.4/BA.5 approuvé), et aucune donnée sur les taux de protection clinique. Le vaccin BA.4/BA.5 approuvé, quant à lui, n’a fait l’objet d’aucun essai sur l’homme jusqu’à présent. Et les données de ses essais sur les animaux n’ont pas non plus été rendues publiques.
L’autorisation par la FDA d’un vaccin contenant les sous‑variants BA.4/BA.5 sur la base de données partielles d’un autre vaccin contenant la séquence d’ARNm du sous‑variant BA.1 est déroutante.
En ce qui concerne le nouveau vaccin de Pfizer, un article publié dans le magazine Science a révélé que les données de seulement huit souris vaccinées avec le vaccin de rappel bivalent BA.4/BA.5 (troisième dose) étaient disponibles lors de la réunion en juin de la FDA. Fin août, au moment où le vaccin bivalent BA.4/BA.5 de Pfizer a été approuvé par la FDA ces données n’étaient toujours pas rendues publiques.
Il s’agit d’une situation tout à fait exceptionnelle pour un type de vaccin aussi nouveau, appliqué pour répondre à un virus qui évolue très rapidement.
La FDA a déclaré qu’on ne pouvait attendre. Face à cette situation de pandémie, attendre tous les résultats nécessaires, c’est manqué l’occasion de sauver des gens.
Les responsables de la FDA ont également comparé la production des vaccins Covid‑19 aux vaccins contre la grippe qui sont actualisés chaque année. Sur la base de cette comparaison, ils considèrent avoir toutes les preuves nécessaires pour soutenir leur décision.
Deux risques majeurs associés à la conception des nouveaux vaccins de rappel
La FDA a probablement de bonnes intentions mais cela ne compense pas le manque de preuves scientifiques. Bien des chercheurs s’inquiètent depuis le début quant à l’incertitude liée à la conception des vaccins Covid, compte tenu de la mutation rapide du virus, des variants et sous‑variants.
1. La mutation rapide des souches virales rend difficile la conception d’un vaccin
Ainsi, un article publié en juin 2022 dans la revue Nature soulignait que la mutation rapide des variants complique d’autant l’actualisation des vaccins. Les variants émergents et les réponses immunitaires aléatoires font qu’il est toujours difficile de déterminer à quoi devrait ressembler un nouveau vaccin.
Le graphique ci‑dessous montre les mutations rapides des sous‑variants d’Omicron. En mars 2022, le BA.1 suscitait beaucoup d’intérêt, et l’on supposait que le BA.1 allait durer un moment.
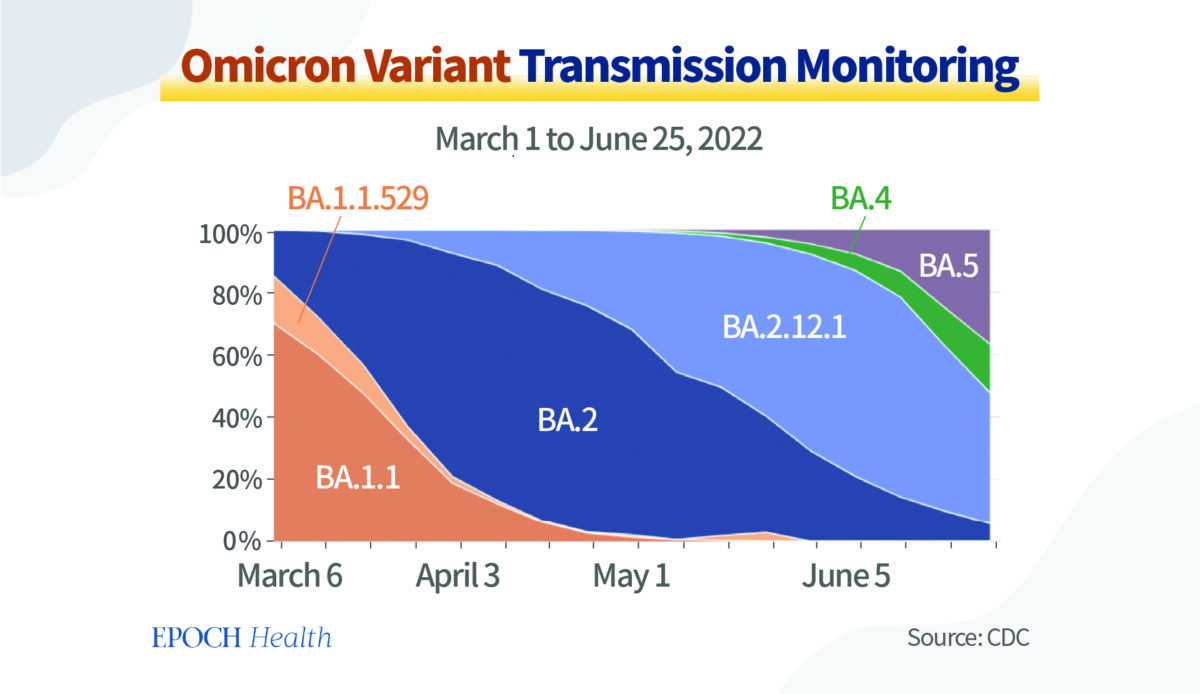
Cependant, les circonstances ont rapidement changé. La souche virale Omicron a produit une nouvelle génération presque tous les deux mois, et actuellement, les sous‑variants BA.4 et BA.5 représentent plus de 90% des nouvelles infections.
Dès le début, les virologues étaient assez perplexes face à la mutation rapide du virus SRAS‑CoV‑2. Il était tout à fait possible qu’un variant totalement nouveau apparaisse à partir d’une des branches de l’arbre généalogique du SRAS‑CoV‑2. Si les prochains vaccins étaient basés sur le sous‑variant original Omicron BA.1, il était probable que les souches Omicron prévalentes seraient différentes lorsqu’elles seraient administrées plus tard en 2022.
Et c’est exactement ce qui s’est passé.
Par ailleurs, les scientifiques ont également averti qu’une actualisation des vaccins Covid‑19 n’est pas aussi simple. Il ne s’agit pas d’échanger l’ARNm basé sur le matériel génétique de l’ancienne souche virale et de le remplacer par l’ARNm d’un autre variant.
Pour donner un exemple simple, lorsqu’on fabrique des vêtements, on peut couper une partie du tissu et la recoudre avec un nouveau morceau de tissu. Ce n’est toutefois pas le cas lorsqu’on actualise un vaccin.
Tout phénomène biologique qui implique le corps humain et peut modifier sa structure ou sa fonction est complexe, multidimensionnel et multiforme.
Si une nouvelle séquence d’ARN viral du SRAS‑CoV‑2 est ajoutée directement à la plateforme vaccinale originale et administrée dans l’organisme, aura‑t‑on vraiment l’effet escompté ?
2. Risque d’effet ADE : facilitation de l’infection par des anticorps
Nous craignons que les conséquences soient beaucoup plus complexes qu’on ne le pense. Une des principales raisons est que les anticorps induits par le vaccin ne sont pas d’un seul type mais plutôt un groupe hétérogène de protéines. Il existe de « bons » et de « mauvais » anticorps.
Lorsque le vaccin à ARNm pénètre dans le corps, le système immunitaire de l’organisme peut générer divers anticorps contre le fragment complet de l’ARNm de la protéine spike.
Les anticorps neutralisants sont protecteurs et se lient étroitement aux protéines spike à la surface du virus et entourent ainsi le virus. Les virus entourés seront éliminés avec succès par les cellules immunitaires.
Les anticorps neutralisants sont donc de « bons anticorps » et leur puissance est testée dans les essais cliniques de phase III des vaccins.
Cependant, il existe des anticorps qui, au lieu de protéger l’individu contre l’infection, favorisent en réalité l’infection. Ces « mauvais anticorps » se lient également aux protéines à la surface du virus, mais de manière assez lâche, de sorte qu’ils n’ont pas le pouvoir de contribuer à l’élimination du virus. Au contraire, ils facilitent certains mécanismes qui permettent au virus d’entrer dans les cellules de l’organisme. Ils renforcent de ce fait l’infection virale. C’est ce qu’on appelle la facilitation de l’infection par des anticorps, ou l’effet ADE (de l’anglais Antibody‑dependent enhancement).
L’ADE a pour résultat de favoriser l’infection au lieu de protéger contre l’infection.
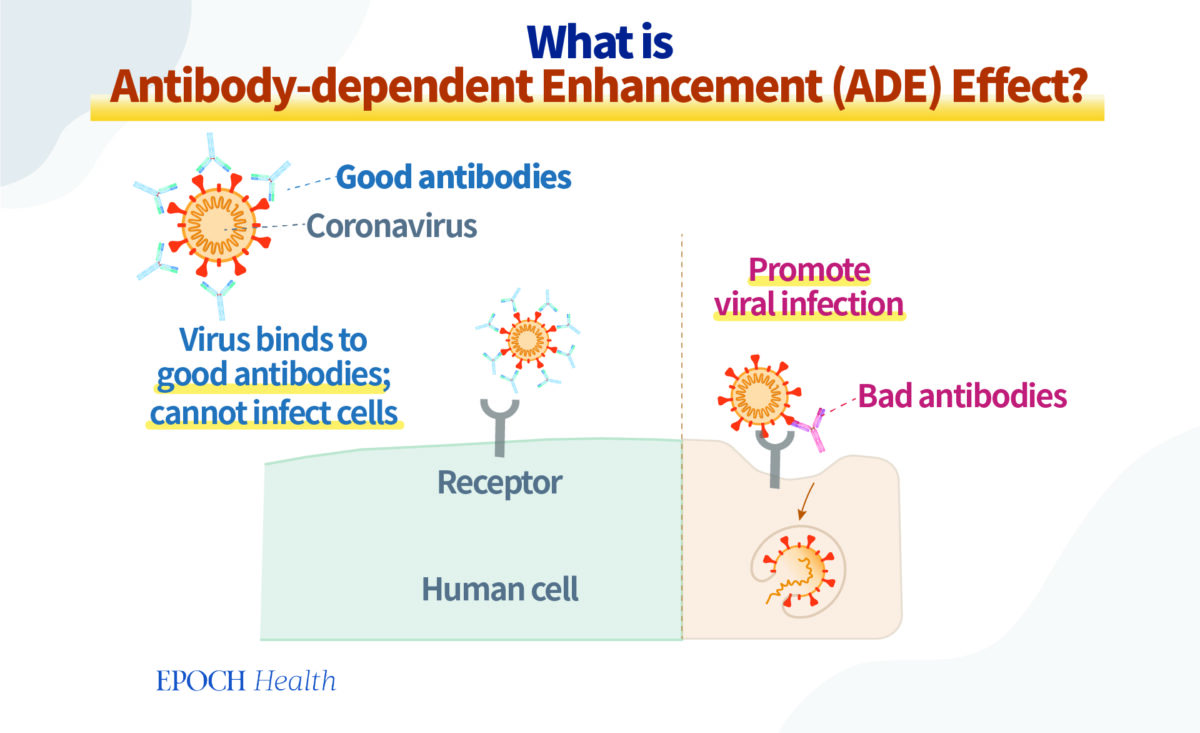
Certes, en théorie, le vaccin produit des anticorps protecteurs une fois injecté dans le corps, et idéalement, c’est le résultat recherché. Mais, en réalité, il peut aussi produire d’autres anticorps, des bons comme des mauvais. Ce type de vaccin constitue donc une arme à double tranchant.
Au jour d’aujourd’hui on a identifié une quarantaine de virus qui peuvent entraîner une réponse immunitaire enclenchant des « anticorps facilitants ». Ce phénomène est dangereux lorsqu’on développe un vaccin. Un vaccin mal conçu peut provoquer la production d’anticorps facilitants qui aggraveront ensuite la maladie au lieu de l’éliminer.
Le phénomène a d’abord été découvert dans le virus de la dengue, puis dans le SRAS et le MERS.
Trois éléments de preuve expérimentale de l’effet ADE
Plusieurs chercheurs ont publié des articles dans diverses revues faisant autorité sur les éventuels risques d’ADE induits par le développement de nouveaux vaccins Covid‑19.
Une étude publiée en 2020 dans l’International Journal of Infectious Diseases a résumé les mécanismes ADE en relation avec le virus SRAS‑CoV‑2. Un total de cinq mécanismes ADE potentiels ont été identifiés et discutés. Il y a notamment un mécanisme qui met en jeu la liaison du fragment cristallisable (Fc) des anticorps aux récepteurs de surface des cellules et l’activation qui en résulte.
Un article paru en 2020 dans la revue Nature Microbiology indiquait deux conséquences de l’ADE : l’augmentation de l’infection virale et l’exacerbation de la maladie après l’infection.
Les deux articles mentionnés ci‑dessus sont des discussions théoriques. Quelles sont donc les preuves expérimentales d’ADE ?
Le développement du vaccin contre le SRAS en est un merveilleux exemple. Après l’épidémie de SRAS survenue en 2003, la communauté médicale a commencé à étudier les vaccins contre le SRAS. En conséquence, les chercheurs ont découvert l’effet ADE dans des expériences in vitro, et in vivo sur des primates et des humains.
En raison de l’effet ADE, le développement des vaccins contre le SRAS a finalement échoué.
Exemple 1 : effet ADE chez la souris
Le Dr Gary Nabel, des Vaccine Research Center (VRC), National Institute of Allergy and Infectious Diseases (NIAID) et National Institutes of Health (NIH), a analysé l’impact des protéines spike de différentes souches du SRAS sur l’effet ADE en 2004.
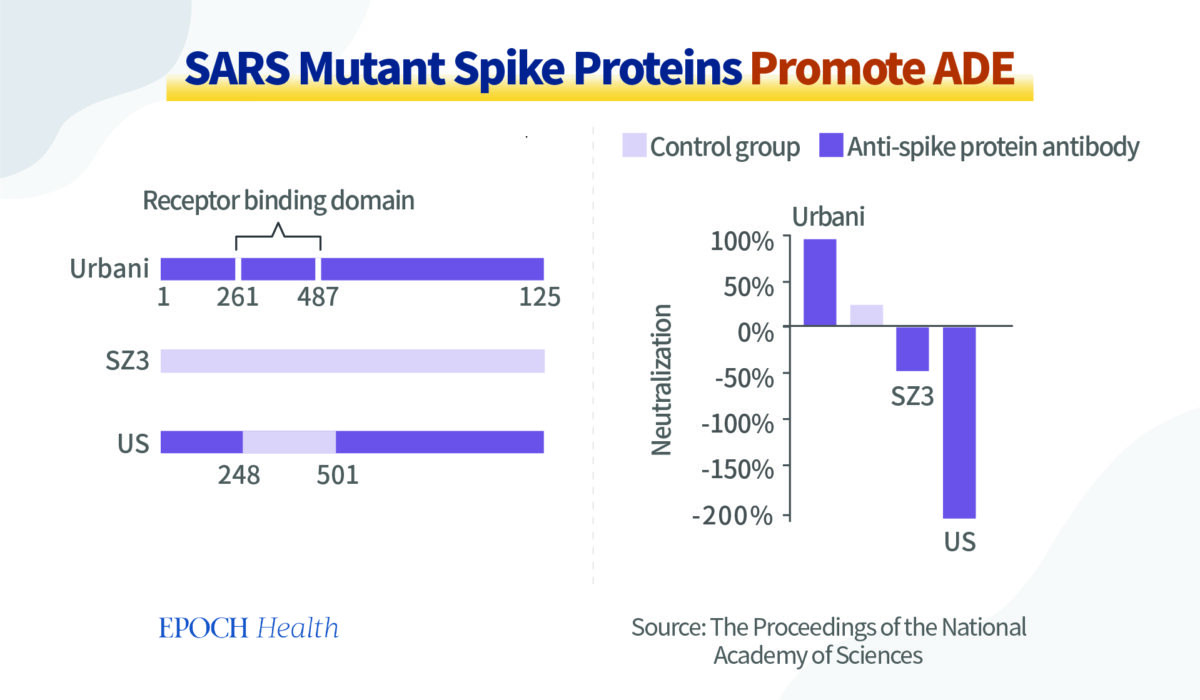
Avec son équipe, il a injecté à certaines souris les protéines spike des souches Urbani et SZ3 du virus du SRAS, ainsi que deux virus chimères SU et US.
Au total, il n’y avait que 17 différences d’acides aminés dans ces fragments de protéines spike, dont 5 seulement dans les régions de liaison aux récepteurs de ces fragments.
Les résultats des expériences sur les anticorps neutralisants ont révélé que les anticorps produits chez les souris après avoir été induits par les fragments de protéine spike de la souche virale Urbani ont agi comme un neutralisant. Autrement dit, il s’agit de la production des bons anticorps susmentionnés, qui protègent les cellules normales de l’infection, comme le montre la colonne la plus à gauche du graphique ci‑dessous.
Si l’on modifie la souche virale Urbani en introduisant un domaine de liaison au récepteur de spike provenant d’une autre souche virale SZ3, on obtient un virus chimère US. Les anticorps produits à l’origine par l’ancienne souche virale (Urbani) chez la souris n’agissent plus comme un agent neutralisant. Au lieu de cela, ils ont un effet ADE. En d’autres termes, non seulement les anticorps n’ont aucun effet protecteur, mais ils favorisent également l’infection des cellules par le virus « muté », comme le montre la plus longue colonne plongeant vers le bas sur le graphique.
La situation est similaire pour le Covid. Lorsque les vaccins Covid‑19 basés sur la souche Wuhan au début de l’année 2020 ont été appliqués à l’échelle mondiale depuis 2021, les anticorps générés contre cette ancienne souche n’ont pas nécessairement protégé les personnes contre les virus du SRAS‑CoV‑2 nouvellement mutés, mais ont davantage favorisé l’action des mutations qui viendraient ultérieurement de type Alpha, Gamma, Delta ou Omicron.
Exemple 2 : Infection facilitée chez des patients atteints du SRAS
Un autre exemple est une expérience cellulaire in vitro menée par des chercheurs du Japon et de la Chine.
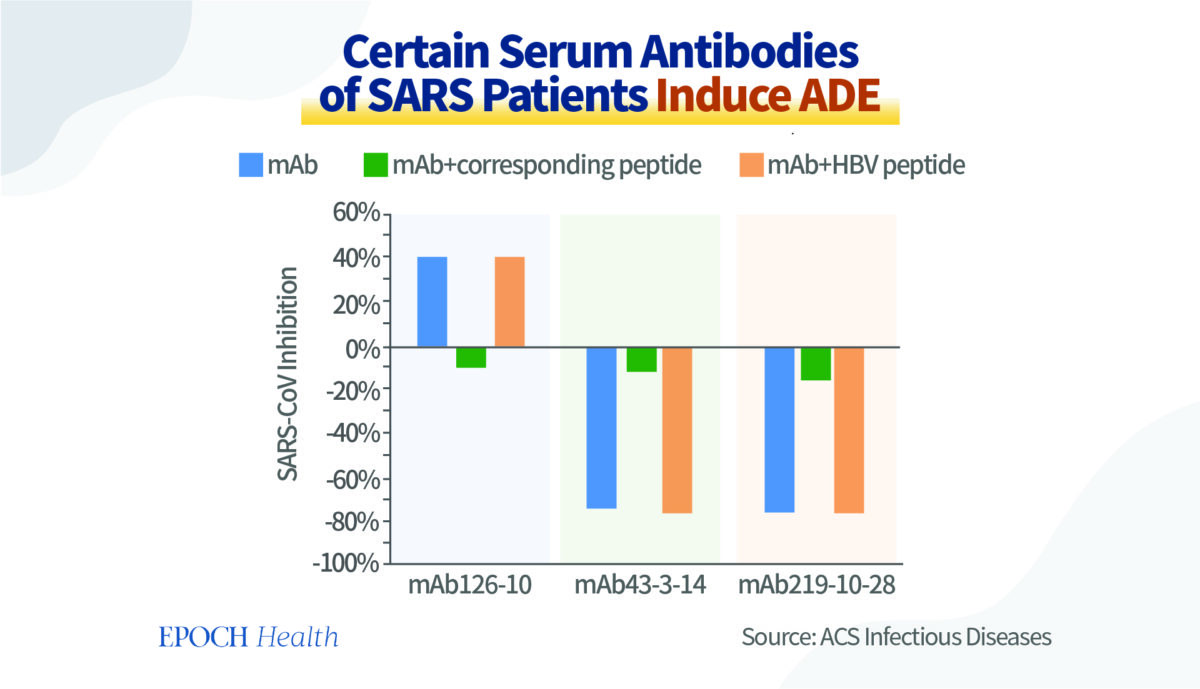
Les chercheurs ont utilisé dans leur étude les sérums contenant des anticorps provenant de patients atteints du SRAS. Dans des expériences in vitro, ils ont découvert que les anticorps produits contre certains fragments d’antigènes avaient la capacité de neutraliser le virus et de prévenir efficacement l’infection, tandis que d’autres favorisaient l’infection.
Comme le montre le graphique ci‑dessous, les barres bleues représentent la capacité des différents anticorps à empêcher le virus de pénétrer dans les cellules. Par conséquent, l’anticorps le plus à gauche protège les cellules. En revanche, les deux autres anticorps non seulement n’ont aucun pouvoir protecteur, mais ils favorisent également l’infection virale des cellules.
Exemple 3 : facilitation de la pathologie
Dans la troisième étude utilisant des singes rhésus, les chercheurs ont administré le vaccin inactivé contre le SRAS par voie intramusculaire aux singes. Ils ont ensuite fait une seconde injection 14 jours plus tard. Deux semaines suivant la seconde injection, les animaux ont été soumis à une inoculation de SARS‑CoV par les fosses nasales. En d’autres termes le virus a été déposé dans leurs fosses nasales.
Les animaux ont ensuite été exécutés au bout six jours, et leurs tissus pulmonaires ont été prélevés et examinés afin de déterminer si le vaccin les avait protégés.
Après l’exposition post‑vaccinale au virus, les singes protégés présentaient dans leurs tissus pulmonaires des parois alvéolaires légèrement élargies, sans anomalie significative.
Les singes non vaccinés et infectés par le SRAS présentaient des parois alvéolaires élargies et une infiltration visible de macrophages avec hyperplasie de l’épithélium alvéolaire.
Par contre, les singes ayant subi un effet ADE après l’exposition post‑vaccinale au virus présentaient des parois alvéolaires plus larges, des parois alvéolaires fracturées, une infiltration de macrophages et de lymphocytes, de la fibrine intra‑alvéolaire et un œdème.
Cette étude fournit des preuves que la pathologie était exacerbée suite à un effet ADE chez les primates exposés au virus du SRAS après vaccination.
Les nouveaux vaccins de rappel oméga bivalents peuvent augmenter le risque d’effet ADE
Il existe une région dans les virus qu’on appelle le domaine de fixation au récepteur de la protéine spike [dit RBD, plus simplement, pour receptor‑biding region]. D’après les résultats de la recherche il est clair que lorsque le virus mute, notamment au niveau du RBD, les anticorps ne parviennent plus à l’empêcher de pénétrer dans les cellules. Au contraire, des effets défavorables d’infection accrue ou de gravité accrue de la maladie se produisent.
Par exemple, à l’origine, les virus ne pénètrent dans les cellules que par une seule porte, celle du récepteur ACE2. Cependant, ces variants d’anticorps viraux ouvrent une « porte latérale » permettant à ces virus d’infecter les cellules humaines par d’autres moyens.
Même s’il n’était pas facile pour un certain virus d’envahir les cellules humaines, ils y parviennent désormais grâce à ces anticorps.
La région mutée la plus courante est le domaine de fixation au récepteur RBD, et c’est également la principale partie mutée des sous‑variants BA.1, BA.4 et BA.5.
Toutes les informations ci‑dessus prouvent donc clairement une chose : après la mutation d’un virus, le gène viral muté ne peut pas être simplement remplacé pour fabriquer un nouveau vaccin utilisé à grande échelle dans la population.
Les anticorps produits après la mutation du gène viral sont très complexes, et les anticorps facilitants jouent le rôle inverse de celui prévu. Par conséquent, le développement d’un nouveau vaccin doit être étudié et analysé pour déterminer le type d’anticorps que le vaccin induit.
La fabrication d’un nouveau vaccin ne consiste donc pas simplement à remplacer le « contenu » par l’ARNm des sous‑variants BA.4/BA.5.
Si les vaccins nouvellement autorisés sont largement utilisés dans une population, au moment où la prochaine vague de variants du virus devient prévalente, les nouveaux variants sont susceptibles d’être à nouveau différents des sous‑variants BA.4 et BA.5 actuels. Certains des anticorps anti‑BA.4 et BA.5 qui restent dans l’organisme humain peuvent se lier à certaines des protéines spike à la surface des nouveaux variants et jouer un rôle neutralisant. Cependant, il est également possible que d’autres anticorps jouent un rôle dans la stimulation de l’infection par les nouveaux variants.
La concentration d’anticorps neutralisants n’est qu’un côté de la médaille. Il y a un autre côté : l’effet ADE, qui doit être soigneusement pesé.
En réalité, ce risque a toujours existé, car le virus du SRAS‑CoV‑2 a toujours évolué, et les populations ont été vaccinées contre la souche obsolète du virus de 2020.
À ce jour, nous n’avons vu aucun fabricant de vaccins déclarer publiquement qu’il avait réalisé des expériences pour exclure les risques d’ADE. Aucun fabriquant n’a trouvé la solution pour que ses vaccins n’induisent pas d’effet ADE.
Finalement, ce que nous voyons le plus souvent, ce sont des données cliniques, ou des données d’enquêtes épidémiologiques, où les pays avec des taux de vaccination élevés ont vu une augmentation au lieu d’une diminution des taux d’infection.
Une étude publiée en 2021 dans l’European Journal of Epidemiology a examiné la relation entre le pourcentage de la population entièrement vaccinée (c.‑à‑d. ayant reçu deux doses du vaccin Covid‑19) et les nouveaux cas de Covid‑19 dans 68 pays et 2947 comtés des États‑Unis.
Les résultats étaient surprenants.
Les pays avec les taux les plus élevés de vaccination complète présentaient les taux les plus élevés, et non les plus faibles, de cas de Covid‑19 pour 1 million de personnes au cours des sept derniers jours.
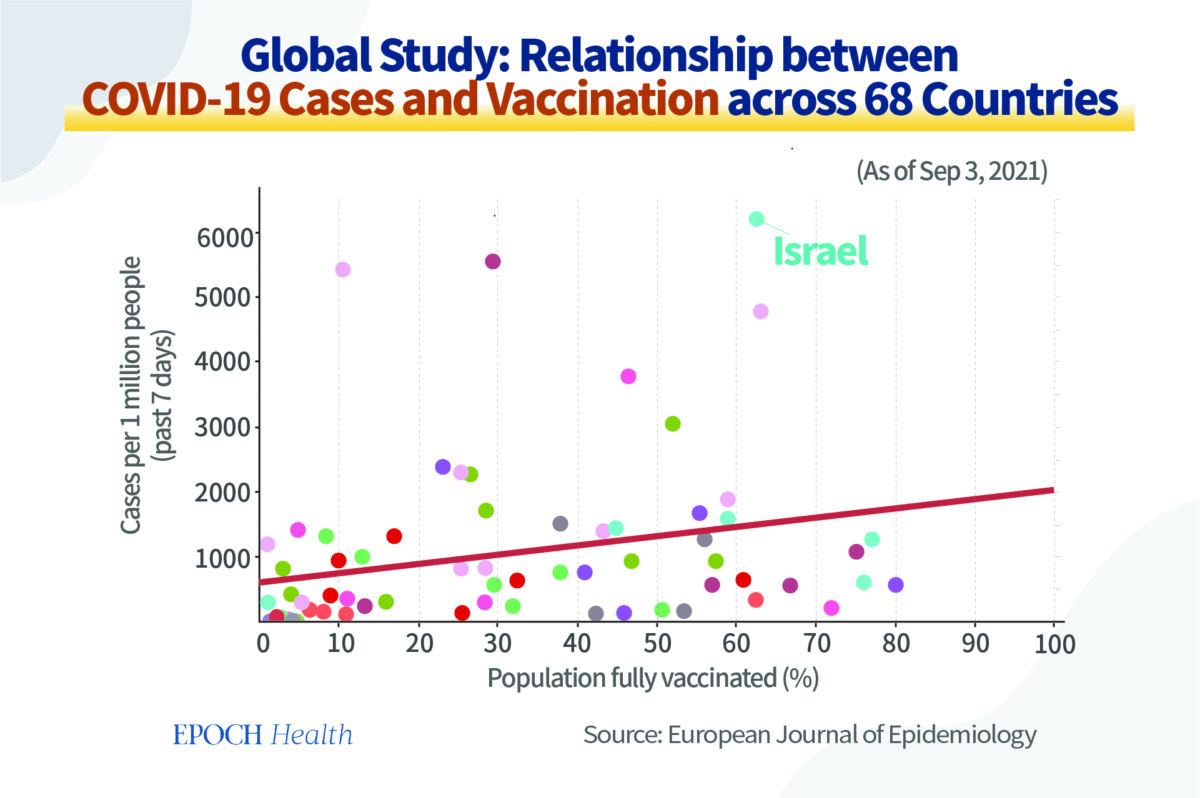
Prenons quelques exemples.
Israël a un taux de vaccination complète de plus de 60%. Il a enregistré 6224 nouveaux cas de Covid‑19 pour 1 million d’habitants, soit le nombre le plus élevé des 68 pays. Au Vietnam et en Afrique du Sud, où le taux de vaccination complète est de 10%, le nombre de nouvelles infections pour 1 million d’habitants était respectivement de 820 et 870.
Ces données devraient amener les gens à réfléchir sur la possibilité que les anticorps produits après la vaccination sont à l’origine d’un effet ADE qui augmente le risque d’infection.
Les nouveaux vaccins Omicron seront largement utilisés dans la population, nous ne pouvons donc pas ignorer l’exploration expérimentale de l’effet ADE. Il s’agit en effet d’un problème majeur qui affecte la vie et la santé d’un grand nombre de personnes.
Les vaccins Covid‑19 sont‑ils comparables aux vaccins contre la grippe ?
On est en droit de se poser la question : le virus de la grippe a des souches différentes chaque année, et le vaccin contre la grippe est actualisé chaque année et développé à un rythme rapide. Le développement annuel du vaccin contre la grippe peut‑il être appliqué aux vaccins Covid‑19 ?
Ma réponse est non, bien que les responsables de la FDA aient une opinion différente.
Tout d’abord, les vaccins contre la grippe sont sur le marché depuis 1945. Les vaccins contre la grippe sont de deux types : vaccins inactivés et atténués. La plateforme technique est relativement mature, ce qui correspond à l’approche traditionnelle du développement des vaccins.
En revanche, les vaccins Covid‑19 existants sont des vaccins à ARNm, un type de vaccin relativement nouveau. Les dommages connus des vaccins à ARNm sur le corps humain incluent des dommages aux mitochondries, la suppression du système immunitaire, des dommages au mécanisme de réparation de l’ADN et des dommages au niveau du système sanguin.
Au cours de cette pandémie de Covid‑19, c’est la première fois que les vaccins à ARNm étaient utilisés à grande échelle sur l’homme.
Deuxièmement, le programme annuel de vaccination contre la grippe n’est pas nécessairement une référence pour les personnes qui doivent faire face à des virus en constante évolution.
Les gens semblent être habitués à être vaccinés chaque année par un nouveau vaccin contre la grippe fabriqué en fonction de la nouvelle souche prédite. Mais quelle est l’efficacité du vaccin contre la grippe utilisé chaque année ?
Dans une analyse approfondie publiée dans The Lancet en 2012, l’efficacité du vaccin contre la grippe pour protéger les adultes était de 59%.
Quelle est l’efficacité des vaccins contre la grippe aujourd’hui ?
Selon les données de l’analyse provisoire du site des CDC, l’efficacité du vaccin contre la grippe n’était que de 34 à 35% entre 2021 et 2022, ce qui est bien inférieur aux 50% minimum exigés par l’OMS.
Une étude parue dans Medical Virology a constaté le même effet ADE suite aux vaccins contre la grippe. La relation entre la baisse du taux de protection et l’effet ADE induit par la vaccination doit être examinée.
Les organismes de réglementation doivent inclure certains éléments dans leur évaluation des risques liés aux vaccins
Le virus du SRAS‑CoV 2 évolue très rapidement et les vaccins sont conçus principalement à partir de la nouvelle plateforme vaccinale à ARNm. À l’avenir, il faut souligner qu’il sera essentiel pour les organismes de réglementation d’évaluer le risque d’anticorps facilitants dans les études animales et les études cliniques sur les vaccins.
Outre l’ADE, un autre risque de complication est la maladie respiratoire renforcée, un mécanisme associé aux anticorps facilitants, et qui a été observé dans les études animales des vaccins contre le SRAS et le MERS.
Lors de la fabrication de nouveaux vaccins, outre les expériences de cytologie in vitro et les études sur l’homme visant à vérifier le titre des anticorps neutralisants, d’autres paramètres immunitaires pertinents (par exemple, la réponse des cellules T et le profil des cytokines) doivent être examinés pour vérifier s’ils indiquent ou non la réponse immunitaire Th1 souhaitée.
Il est nécessaire d’utiliser différents modèles animaux pour détecter les risques liés aux anticorps facilitants, ou aux maladies respiratoires renforcées. Il est nécessaire d’évaluer la sécurité d’un nouveau vaccin Covid‑19. Tous les tests susmentionnés sont possibles avant de procéder à des essais sur l’homme. Toutes les données devraient également être rendues publiques. La pratique actuelle consistant à promouvoir aveuglément des injections de rappel de vaccins sans procéder à l’évaluation nécessaire de leur sécurité peut entraîner des risques pour la santé des personnes qui recevront ces vaccins à l’avenir. Pour éviter que cela se produise, il est important d’anticiper les événements indésirables potentiels.
La fabrication d’un vaccin ne consiste pas à assortir bêtement les pièces d’un puzzle.
Comment pouvez-vous nous aider à vous tenir informés ?
Epoch Times est un média libre et indépendant, ne recevant aucune aide publique et n’appartenant à aucun parti politique ou groupe financier. Depuis notre création, nous faisons face à des attaques déloyales pour faire taire nos informations portant notamment sur les questions de droits de l'homme en Chine. C'est pourquoi, nous comptons sur votre soutien pour défendre notre journalisme indépendant et pour continuer, grâce à vous, à faire connaître la vérité.















